Основы газификации
В основных зонах газогенератора - окислительной (горение) и восстановительной - протекают реакции как между углеродом топлива и кислородом дутья, так и между продуктами процесса и исходными реагентами. Реакции между твердыми телами и газами, протекающие на поверхности раздела фаз, носят название гетерогенных, а реакции между газами, протекающие в объеме, занимаемом реагентами, называются гомогенными.
Химическая реакция сопровождается выделением или поглощением тепла. В первом случае реакции называются экзотермическими, во втором - эндотермическими. В табл. IV-6 приведены тепловые эффекты реакций, имеющих место в процессе газификации топлива.
Гетерогенная реакция взаимодействия дутья и раскаленного углерода может быть схематически расчленена на три процесса: подвод дутья к раскаленному углероду, взаимодействие между поверхностью углерода и окислителем с образованием продуктов реакции и, наконец, удаление продуктов реакции.
Первый и третий процессы подчиняются законам диффузии и интенсивность Их определяется скоростью диффузии, так как продолжительность самой реакции очень мала.

Второй процесс подчиняется законам кинетики химических реакций. Законам кинетики подчиняются также гомогенные реакции, если реагирующие газы представляют собой весьма совершенную и однородную смесь.
В ходе реакции имеет место уменьшение концентрации исходных веществ и увеличение концентрации конечных продуктов.
Изменение концентрации в единицу времени называют скоростью реакции. В простейшем случае мономолекулярной реакции при одинаковом изменении концентраций реагирующих веществ.
Согласно закону действующих масс скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
В процессе реакции в результате взаимодействия исходных образуются новые вещества, между которыми возможно протекание обратной реакции. По мере накопления молекул новых веществ концентрация их увеличивается и скорость обратной реакции возрастает. В течение определенного времени устанавливается динамическое равновесие. Это означает, что обратимая реакция не может привести к полному исчезновению исходных веществ (как это может быть представлено стехиометрическими уравнениями).
В реакциях, протекающих с изменением объема, на состав равновесной смеси кроме температуры влияет еще и величина давления.
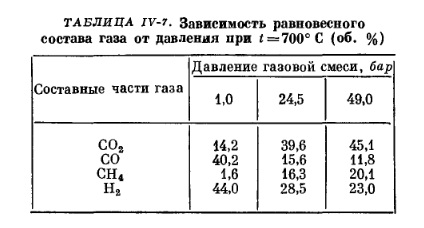
Зная температуру, давление и значение константы равновесия, можно определить состав равновесной смеси.
При изменении условий протекания реакции, т. е. температуры или давления, происходит смещение равновесия в сторону реакции, стремящейся ослабить произведенное изменение (принцип Jle Шателье). Например, если повысить давление при протекании обратимой реакции в замкнутом объеме при постоянной температуре, то повысится скорость той реакции, при которой будет уменьшаться число молекул конечного продукта, что вызовет снижение давления. Этим объясняется изменение равновесного состава газа в сторону увеличения в нем более тяжелых компонентов при повышении давления. В табл. IV-7 приведена зависимость равновесного состава газа от давления.
В тех случаях, когда в результате реакции число молекул газов не меняется, изменение давления не нарушает равновесия.
Кроме указанных в восстановительной зоне могут протекать другие сопутствующие реакции.
По гипотезе 3. Ф. Чуханова, последовательность реакций такова, что вначале образуется сложный углеродпо-кислородный комплекс С304, распадающийся па С02 и СО. Одновременно протекает реакция образования окиси углерода по уравнению (б).
Так как большинство рассмотренных реакций обратимо, то очевидно, что углерод топлива не может перейти только в СО, а водяные пары полностью выделить связанный водород. Тем не менее для оценки действительных процессов газификации топлива полезно рассмотреть идеальные газогенераторные процессы, под которыми понимают процессы полного превращения в горючие газы чистого углерода, протекающие без потерь с теоретически необходимыми количествами реагентов в соответствии со стехиометрическими уравнениями реакций.
В реальных условиях воздушный газ может быть получен в результате продувки раскаленного кокса воздухом, по состав такого газа будет отклоняться от идеального за счет неполного восстановления СО2 в СО, нарушений температурного и аэродинамического режимов в отдельных частях слоя, а также некоторого содержания летучих в коксе. В связи с указанным теплота сгорания газа оказывается более низкой, чем для идеального газа.
Наоборот, при газификации топлив с большим выходом летучих теплота сгорания газа может оказаться заметно выше из-за содержания в нем углеводородпых соединений.
При продувании через раскаленный слой углерода водяного пара получается водяной газ.
Образование водяного газа может протекать при условии под вода необходимого количества тепла.
Это может осуществляться за счет сжигания части углерода перед продувкой паром. Процесс в этом случае протекает циклично. Сначала слой кокса продувается воздухом, нри этом получаются так называемые продувочные газы. После достижения высокой температуры (1100-1300°С) кокс продувается паром попеременно снизу вверх и сверху вниз. Основы газификации показывают по мере охлаждения кокса реакция образования водяного газа замедляется, а качество газа ухудшается.
Коэффициент полезного действия, основы газификации в реальных условиях не превышает 60-65% из-за больших потерь тепла с продувочными газами. Кроме того, из-за обратимости протекающих реакций и подмешивания продувочного газа водяной газ содержит наряду с СО и Н2 некоторое количество С02, Н2О и N2.
Водяной газ самостоятельного значения как промышленное топливо не имеет, однако реакция его получения важна для понимания и расчета образования смешанного (паровоздушного) газа.
Смешанный (паровоздушный) газ в идеальных условиях получается в результате воздействия смеси воздуха и водяного пара па раскаленный углерод.
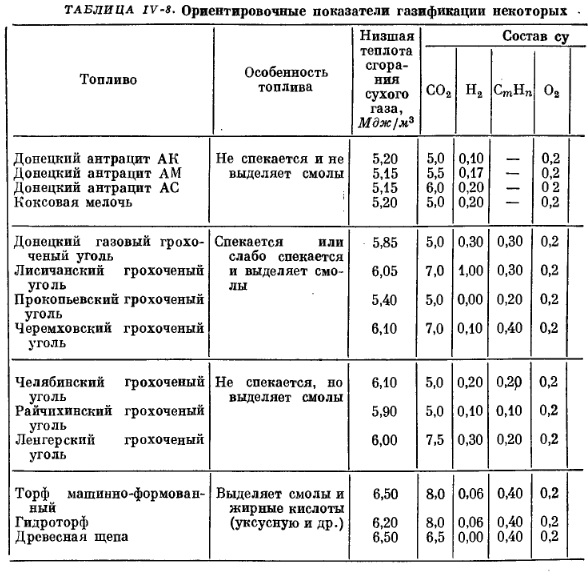
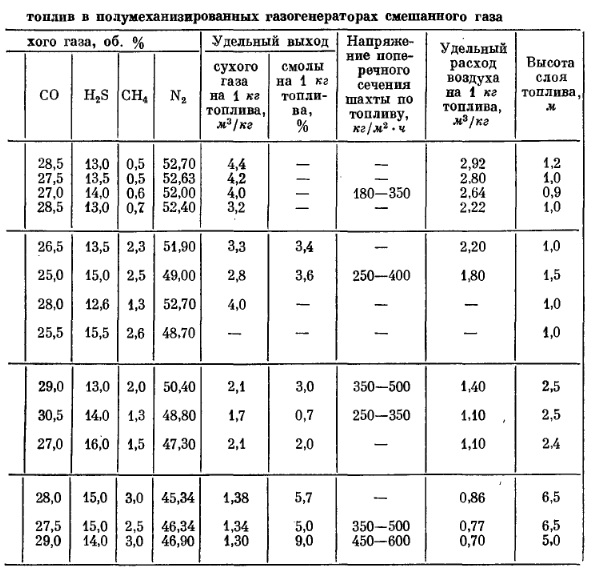
В действительности процесс получения смешанного газа сильно отличается от идеального. В газе наблюдается значительное количество двуокиси углерода (5-8%), более высокое содержание азота, выход сухого газа меньше расчетного. При газификации топлив, богатых летучими веществами, за счет процесса сухой перегонки, протекающей в верхней части шахты, газ обогащается углеводородами, а также водяными парами. Теплота сгорания реального газа колеблется в зависимости от топлива от 5,0 до 6,5 Мдж/м3.
Подавляющее большинство газогенераторных установок, вырабатывающих топливный газ, работает по рассмотренной схеме, так как получение смешанного газа значительно проще, нежели получение водяного газа. В то же время качество его выше, чем воздушного газа. Добавление пара к дутьевому воздуху не только увеличивает теплоту сгорания газа, но и снижает температуру слоя и уменьшает потери с физическим теплом вырабатываемого газа. Шлак в газогенераторах воздушного газа меньше сплавляется, не образует крупных кусков, что улучшает выжиг из него горючих и уменьшает потерю от механического недожога.
В табл. IV-8 приведены основные показатели, характеризующие процессы получения смешанного газа по данным Н. В. Шишакова.